Les cellules souches humaines induites à la pluripotence, un outil précieux pour mieux comprendre et soigner les maladies neuromusculaires
Une revue publiée par deux chercheurs d’I-Stem, un des laboratoires de l’AFM-Téléthon, fait le point sur les cellules souches pluripotentes humaines iPS et confirment leurs principaux atouts dans les maladies neuromusculaires : améliorer la compréhension et identifier de nouveaux traitements.
Décrites pour la première fois en 2006 par le chercheur japonais Shinya Yamanaka, ce qui lui a valu le Prix Nobel de médecine en 2012, les cellules souches pluripotentes induites iPS (pour induced pluripotent stem cells) sont de plus en plus utilisées en laboratoire.
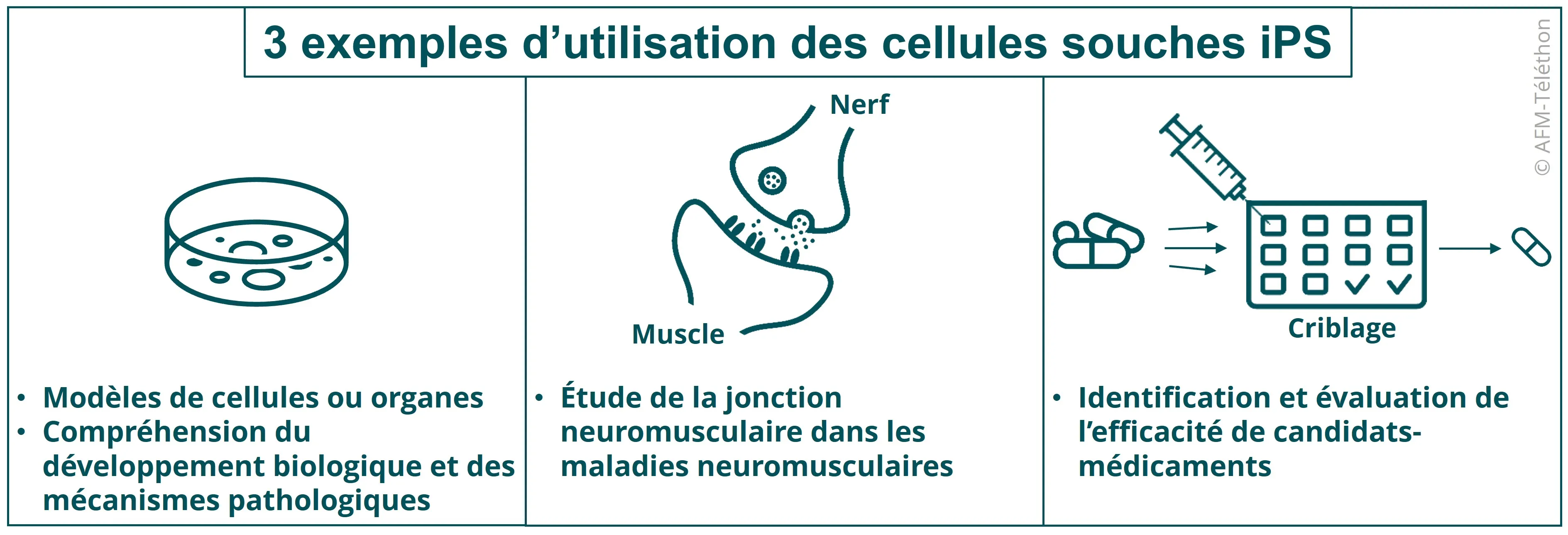
Vous avez dit cellules souches pluripotentes induites iPS ?
On appelle « cellules souches » des cellules indifférenciées capables de s'auto-renouveler et de se différencier afin de donner naissance à n’importe quelles cellules spécialisées de notre organisme (cellules du sang, du muscle, neurones…).
Contrairement aux cellules souches embryonnaires qui proviennent d’un embryon surnuméraire non utilisé après une fécondation in vitro, les cellules iPS sont issues de cellules prélevées chez un adulte qui ont été « rajeunies » pour leur faire retrouver leur capacité à se transformer en tout type de cellules. L’avantage ? Outre celui de s’affranchir des problèmes éthiques liés à la manipulation d’embryon, ces cellules peuvent aussi servir pour modéliser des maladies, comme les maladies neuromusculaires, à condition que les cellules adultes utilisées au départ soient malades.
Reproduire des systèmes complexes comme la jonction neuromusculaire
Cet outil peut ainsi se révéler utile pour modéliser la jonction neuromusculaire, zone de contact entre le motoneurone et sa cible musculaire, qui joue un rôle majeur dans de nombreuses maladies neuromusculaires. Il va permettre d’étudier chaque composant individuellement mais aussi les interactions entre les motoneurones et les muscles, les vésicules synaptiques…
Très récemment, il a été montré que les cellules iPS peuvent servir également pour la mise au point de petits organes appelées « organoïdes ». Ces petites structures tridimensionnelles ressemblent à l’organe entier, permettant de comprendre son développement et son fonctionnement, ou encore de tester de potentiels traitements.
En chiffres
28 jours pour permettre à des cellules iPS de se différencier en motoneurones.
3 mois pour obtenir une jonction neuromusculaire en 3D.
Du laboratoire à l’essai clinique
Des chercheurs de l’institut I-Stem ont ainsi réussi, grâce à un criblage à haut-débit, à identifier la metformine, un antidiabétique déjà sur le marché, comme traitement efficace dans des cellules souches provenant de personnes atteintes de maladie de Steinert. S’en est suivi un essai de phase II qui a concerné 40 participants et montré, après un an de traitement, que les patients traités avec la metformine (contre placebo) ont gagné en motricité et ont retrouvé une démarche plus stable. Un nouvel essai dans la maladie de Steinert est en préparation en France (phase III).
Deux autres candidats-médicaments, le bosutinib et le rétigabine, ont également montré leur efficacité sur des cellules iPS provenant de patients atteints de maladie de Charcot (SLA) avant d’être évalués dans le cadre d’essais cliniques.
I-Stem, l’Institut des cellules souches pour le traitement et l'étude des maladies Monogéniques
C’est en 2005 qu’a vu le jour l’Institut I-Stem, sous l’impulsion de l’AFM-Téléthon et de l’Inserm. Ce laboratoire est spécialisé dans l’utilisation de cellules souches autour de deux axes principaux : la thérapie cellulaire et le criblage pharmacologique à haut débit à partir de cellules modèles de pathologies.
Source
Unlocking the Complexity of Neuromuscular Diseases: Insights from Human Pluripotent Stem Cell-Derived Neuromuscular Junctions
Gazzola M, Martinat C
Int. J. Mol. Sci. 2023 (Oct)
