Duchenne : autorisation aux États-Unis d’une thérapie génique microdystrophine
En juin 2023, les autorités de santé américaines approuvaient un premier médicament de thérapie génique par microdystrophine, l'Elevidys dans la DMD, pour les garçons âgés de 4 à 5 ans, marchants. L'indication a été depuis étendue aux garçons âgés de 4 ans et plus.
Le laboratoire Sarepta Therapeutics a annoncé le 20 juin 2024, l'extension de l'autorisation de mise sur le marché octroyée par la FDA (agence réglementaire du médicament américaine) pour le delandistrogene moxeparvovec-rokl (SRP-9001) le produit de thérapie génique qu’il développe dans la dystrophie musculaire de Duchenne (DMD). Cette autorisation qui concernait dans un premier temps les garçons atteints de DMD, âgés de 4 à 5 ans, marchants, à l’exclusion de ceux porteurs de délétions dans les exons 8 et/ou 9 du gène de la dystrophine (DMD), s'applique désormais aux garçons âgés de 4 ans et plus (avec les mêmes exclusions de délétions d'exons). S'il s'agit d'une autorisation classique pour les participants marchants, elle reste conditionnelle pour les patients non marchants et soumise à l'obtention de résultats d'efficacité clinique.
Cette autorisation ne s’applique pas en Europe, marché pour lequel une demande d'autorisation a été déposée auprès de l'EMA (Agence européenne du médicament) visant les garçons de 3 à 7 ans, marchants (demande en cours d'examen).
Une approbation accélérée pour l’Elevidys, sous conditions
L’analyse d’un essai clinique de phase 2 du SRP-9001 a montré une augmentation significative de la production de microdystrophine trois mois après l’administration du traitement : près de 75 % des fibres musculaires issues de muscles des patients traités (âgés de 4 à 7 ans) sont positives. La production de dystrophine est le critère d’évaluation retenu par la FDA pour répondre favorablement à la demande d’autorisation accélérée de Sarepta. En effet, cette production laisse supposer une certaine efficacité clinique chez les patients traités, mais seuls des résultats d’efficacité peuvent en apporter la preuve. Les premiers résultats de l’essai confirmatoire de phase 3 EMBARK ont été annoncés en octobre 2023 mais d'autres données à long terme sont attendues.
Des effets indésirables non négligeables
Certains participants traités avec l’Elevidys ont dû faire face des événements indésirables : des problèmes hépatiques aiguës graves, une myosite d’origine immunitaire et une myocardite ainsi que des nausées, des vomissements, une augmentation des enzymes du foie, de la fièvre, une baisse des plaquettes sanguines...
« Cette autorisation accélérée exceptionnelle accordée par l’agence du médicament américaine permet de lever un tabou de la thérapie génique de la myopathie de Duchenne. Même s’il faudra attendre les résultats complets des études de phase 3 en cours pour confirmer cette autorisation pour l’Elevidys et son extension en Europe, il n’y a pas de doute que d’autres produits suivront. Cette avancée a aussi été rendue possible par la collaboration des différents acteurs, dont Généthon (par ailleurs partenaire de Sarepta pour son propre produit) à un moment clé des essais cliniques. Il est important aussi de préciser que l’accès à l’Elevidys ne sera pas possible pour tous les malades, notamment du fait des délais de commercialisation et de distribution et aussi du fait qu’une part non négligeable des malades ont déjà été exposés au virus utilisé comme base de l’Elevidys et auront développé des anticorps neutralisants. » anticipe Serge Braun, Directeur scientifique de l’AFM-Téléthon.
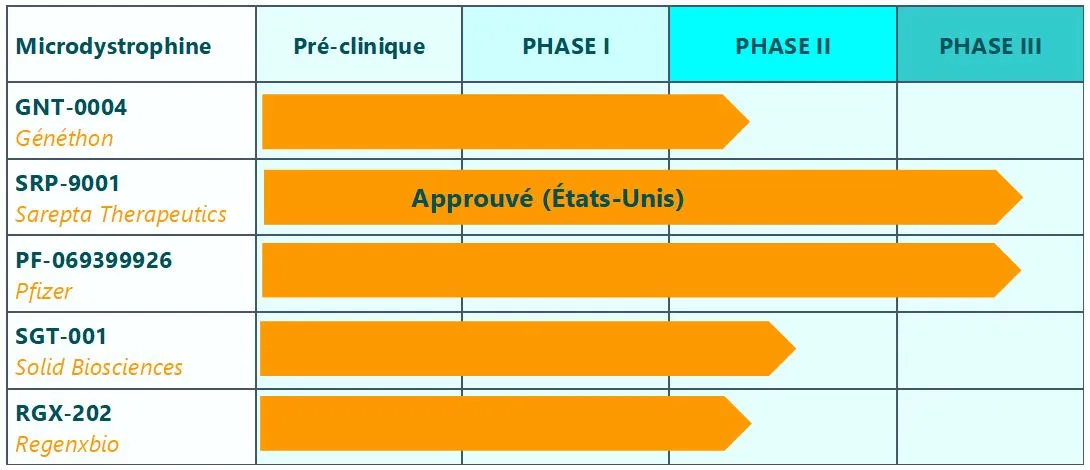
Quatre autres produits de thérapie génique par microdystrophine en essais cliniques
À côté de Sarepta Therapeutics, quatre autres laboratoires développent de telles thérapies géniques, dont Généthon, le laboratoire de l’AFM-Téléthon, promoteur d’un essai clinique en cours qui évalue le GNT-0004 en France. Chaque produit a des spécificités (les régions du gène choisies pour former la microdystrophine, le vecteur qui transporte le gène médicament, son immunogénicité…) qui pourraient les rendre plus adaptés à certains patients qu’à d’autres, pour répondre aux besoins thérapeutiques de chacun.
Source
Sarepta Therapeutics Announces Expanded US FDA Approval of ELEVIDYS to Duchenne Muscular Dystrophy Patients Ages 4 and Above
Sarepta Therapeutics, communiqué de presse, 20 juin 2024
Sarepta Therapeutics Announces FDA Approval of ELEVIDYS, the First Gene Therapy to Treat Duchenne Muscular Dystrophy
Sarepta Therapeutics, communiqué de presse, 22 juin 2023
