FSH : premiers résultats pour le losmapimod
Evalué dans le cadre d’un essai de phase I dans la FSH de type 1 et chez des volontaires sains, le losmapimod serait bien toléré et ciblerait efficacement les muscles.
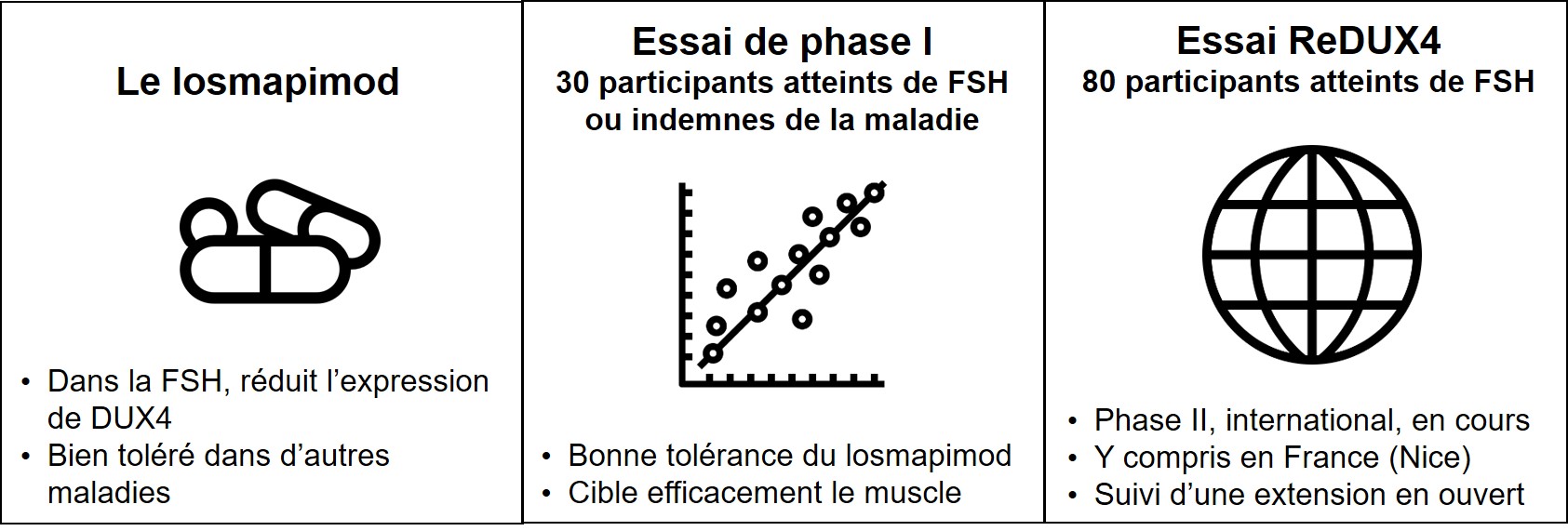
Dans un communiqué de presse du 24 mars 2020, la société Fulcrum Therapeutics annonce la bonne tolérance du losmapimod au cours d’un essai de phase I conduit chez 20 personnes atteintes de myopathie facio-scapulo-humérale de type 1 (FSH1) et 10 volontaires indemnes de cette maladie. Chez les malades, le candidat-médicament se montrerait aussi actif dans les muscles. En témoigne l’inhibition de l’enzyme cible du losmapimod, la MAP-kinase p38, observée sur les biopsies musculaires.
Une molécule réorientée vers la FSH
Conditionné sous forme de comprimés, le losmapimod a été désigné médicament orphelin dans la FSH par les autorités de santé américaines début 2020. Il a déjà été évalué par le passé dans d’autres maladies (infarctus du myocarde, bronchopneumopathie chronique obstructive…) sans montrer d’efficacité mais avec, semble-t-il, une bonne tolérance. Les chercheurs de Fulcrum Therapeutics l’ont retenu après avoir réalisé un criblage moléculaire destiné à identifier, dans des modèles cellulaires, des composés capables de réduire l’expression du gèneDUX4, lequel est anormalement exprimé dans la FSH. Une étude réalisée par une autre équipe, américaine, a confirmé que l’inhibition de p38 réduit l’expression de DUX4 dans des modèles cellulaires et animaux de la maladie.
ReDUX4 et son extension en France
L’essai de phase I du losmapimod avait pour objectif d’évaluer la sécurité d’utilisation, la tolérance et le devenir dans l’organisme de deux dosages du losmapimod (7,5 ou 15 mg/jour) par voie orale en deux prises pendant 14 jours, comparé à un placebo pour certains participants. Ses résultats confortent le choix de la dose de 15 mg de losmapimod, testée depuis août 2019 dans un essai de phase II appelé ReDUX4. L’objectif de ce deuxième essai est d’évaluer la sécurité d’utilisation et l’efficacité pendant 6 mois du losmapimod contre placebo chez 80 personnes atteintes de FSH, âgées de 18 à 65 ans, dans 4 pays dont la France (CHU de Nice). À son terme, tout participant pourra intégrer l’extension en ouvert de l’essai ReDUX4, laquelle évaluera la tolérance et la sécurité d’utilisation du losmapimod à long terme (jusqu’à 5 ans). À noter que le losmapimod fait l’objet d’un autre essai de phase II, en ouvert, aux Pays-Bas avec 14 participants.
Sources
Clinically Advanced p38 Inhibitors Suppress DUX4 Expression in Cellular and Animal Models of Facioscapulohumeral Muscular Dystrophy.
Oliva J, Galasinski S, Richey A, Campbell AE, Meyers MJ, Modi N, Zhong JW, Tawil R, Tapscott SJ, Sverdrup FM.
J Pharmacol Exp Ther. 2019 (Aout) 370(2):219-230.
Communiqué de presse de Fulcrum Therapeutics du 24 mars 2020 « Fulcrum Therapeutics Announces Complete Data from Phase 1 Trial with Losmapimod in Facioscapulohumeral Muscular Dystrophy (FSHD) »
