SMA : le risdiplam (Evrysdi) autorisé en Europe !

Un troisième traitement de la SMA, le risdiplam (Evrysdi), vient d’obtenir une autorisation de mise sur le marché européen, le premier qui s’administre par voie orale !
Après le nusinersen (Spinraza) et l’onasemnogene abeparvovec (Zolgensma), c’est au tour du risdiplam (Evrysdi) d’obtenir une autorisation de mise sur le marché (AMM) en Europe dans le traitement de l’amyotrophie spinale proximale liée à SMN1 (SMA). Administré par voie orale, il peut être pris à domicile, les deux autres étant injectés à l’hôpital.
Qui est concerné par cette AMM ?
Cette AMM européenne concerne les malades âgés de plus de deux mois, avec un diagnostic clinique de SMA de type I, de type II ou de type III ou avec une à quatre copies du gène SMN2.
La Commission Européenne l’a octroyé suite à l’avis positif donné en février dernier par le Comité des Médicaments à Usage Humain (CHMP) de l’Agence Européenne du Médicament (EMA) lequel s’est appuyé sur les résultats positifs obtenus sur un large panel de malades dans le cadre des essais SUNFISH (chez des personnes atteintes de SMA de type II ou III âgées de 2 à 25 ans) et FIREFISH (chez des nourrissons symptomatiques atteints de SMA de type I âgés de 2 à 7 mois).
À ce jour ce sont plus de 3000 patients qui ont été traités par le risdiplam dans le monde.
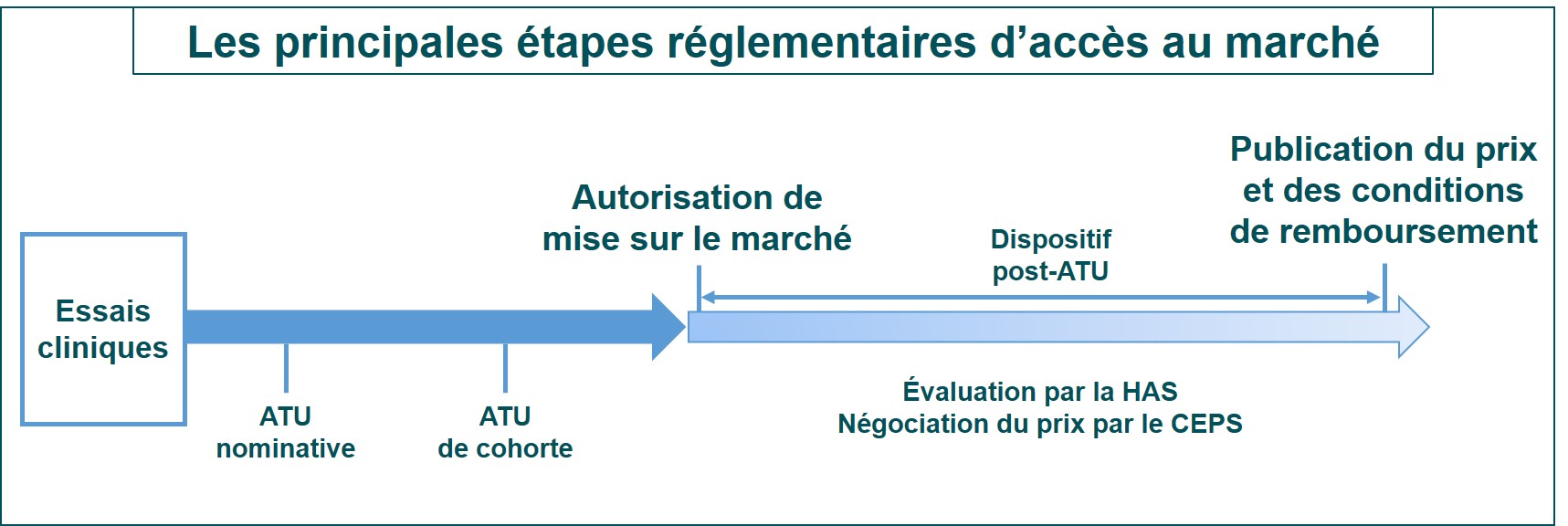
Quelles sont les prochaines étapes ?
Jusqu’au 6 avril 2021, le risdiplam (Evrysdi) est accessible en France via une autorisation temporaire d’utilisation (ATU) nominative pour la SMA de type I et II. À partir de cette date, il le sera par le biais d’une ATU de cohorte pour les malades SMA types I, II et III âgés de deux mois et plus, « en cas d’échec, d’intolérance ou d’impossibilité d’administration des alternatives thérapeutiques disponibles », comme le nusinersen (Spinraza), et après avis d’une Réunion de Concertation Pluridisciplinaire (RCP) nationale de la filière Filnemus.
En France, le risdiplam va maintenant faire l’objet d’évaluations par la Haute autorité de Santé (HAS) et de négociations par le Comité économique des produits de santé (CEPS) permettant d’en fixer le prix et les conditions de remboursement. Ce n’est qu’au bout de ce processus qui va durer pendant de longs mois que l’accès à ce médicament pourra être également ouvert aux malades qui aujourd’hui peuvent déjà bénéficier du nusinersen (Spinraza). Pendant tout ce temps, le risdiplam sera accessible sans reste à charge pour les malades dans les indications fixées par l’ATU de cohorte.
Source
Roche’s Evrysdi approved by European Commission as first and only at home treatment for spinal muscular atrophy. Communiqué de presse du 30 mars 2021. Roche
