ARN messager
Utilisé dans certains vaccins contre la Covid-19, l’ARN messager est une molécule naturellement produite par les cellules pour réguler l’information génétique lors de la fabrication des protéines. Outre son intérêt pour la vaccination contre les maladies infectieuses, il est étudié comme cible thérapeutique dans des maladies génétiques rares ou des maladies plus fréquentes comme certains cancers, des maladies auto-immunes …
Qu’est-ce que l’ARN messager ?
L’ARN messager (ARNm) est une forme d’acide ribonucléotidique (ARN) qui permet de copier et de diffuser l’information génétique, d’où son nom de « messager ».
En effet, le patrimoine génétique (l’ensemble des gènes d’une personne) est essentiellement situé à l’intérieur du noyau de la cellule, sur l’ADN. L’information qu’il renferme sert à fabriquer les protéines grâce auxquelles fonctionnent toutes nos cellules. Elle doit être transmise hors du noyau, au niveau du cytoplasme, là où les protéines sont fabriquées, par les ribosomes. C’est le rôle de l’ARN messager.
D’autres formes d’ARN existent
L’ARN messager n’est pas le seul ARN présent dans la cellule : par exemple l’ARN ribosomique et l’ARN de transfert (qui participent eux-aussi à la fabrication des protéines au niveau des ribosomes) et les micro-ARN (qui régulent la synthèse de protéines cibles) …
De l’ADN à l’ARN messager
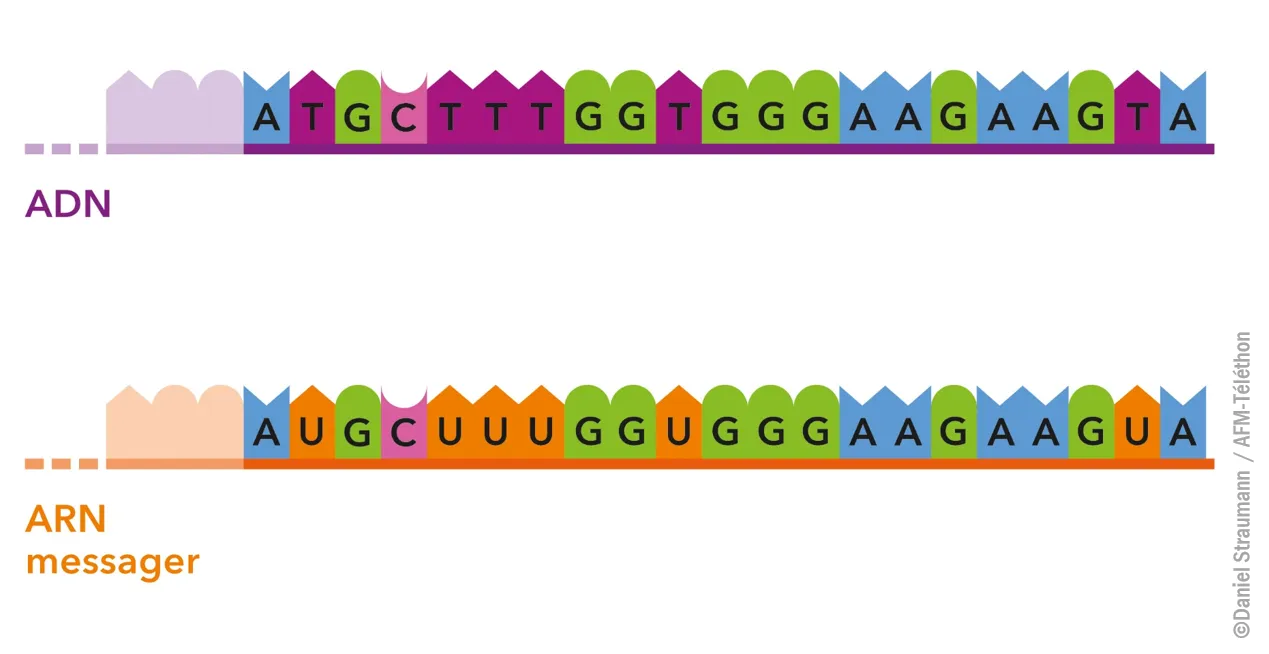
L’ARN et l’ADN ont une structure proche : un squelette (constitué de phosphate et de sucre) sur lequel sont accrochées des bases nucléiques, l’ensemble formant une chaine de nucléotides. On parle d’acide nucléique. L’ordre de succession des nucléotides, ou séquence nucléotidique, constitue un message génétique.
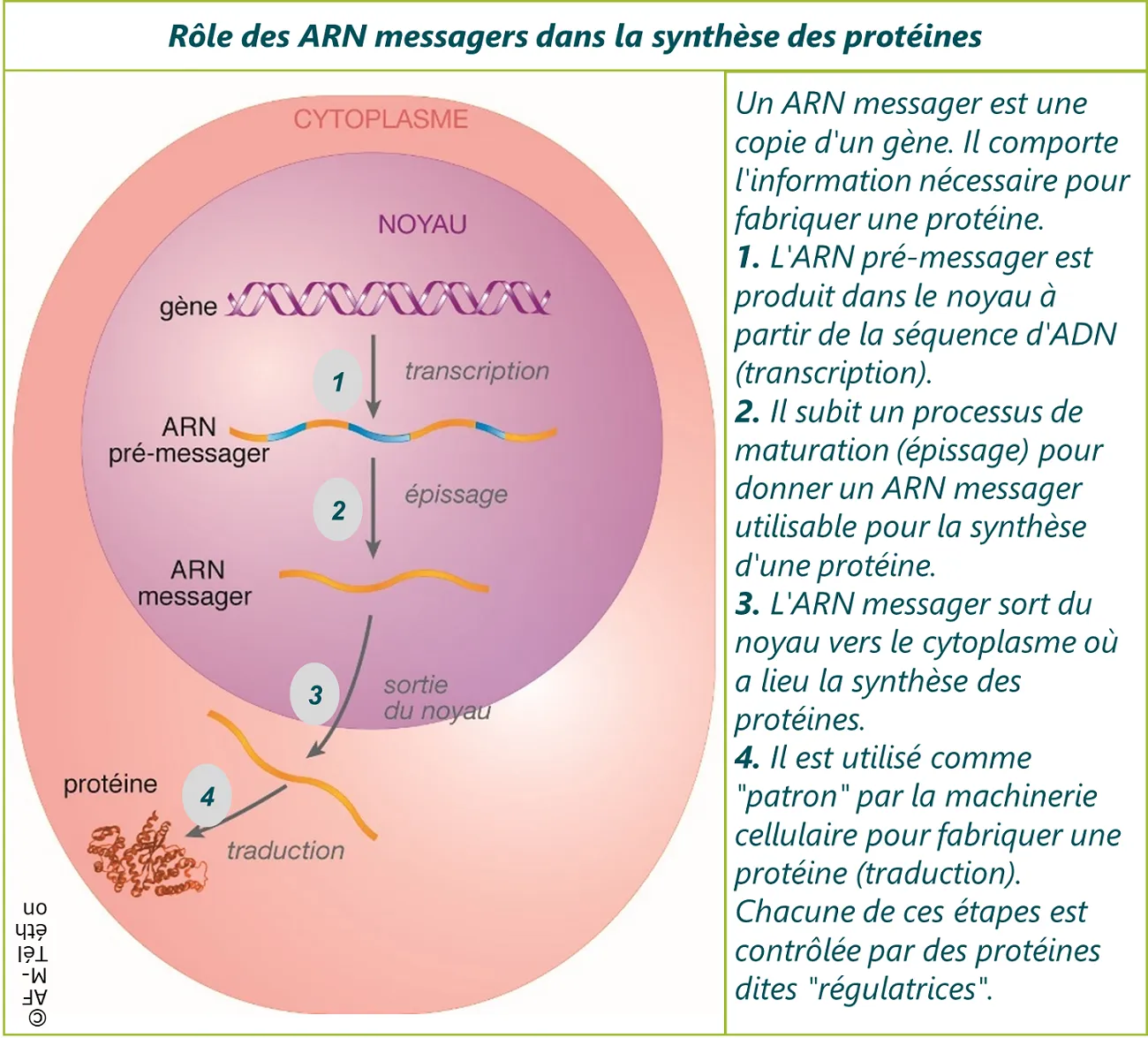
L’ARNm est fabriqué à l’intérieur du noyau :
- Dans un premier temps, la séquence nucléotidique d’un gène (sur l’ADN) est retranscrite sur un ARN appelé pré-messager.
- Puis, l’ARN pré-messager subit une série de modifications au cours desquelles des fragments nucléotidiques sont rajoutés (coiffe et queue poly(A)) et d’autres enlevés (excision des introns et épissage des exons).
- Au fur et à mesure de la maturation de l’ARN messager, différentes protéines se fixent dessus, formant progressivement un complexe. Lorsque le complexe est complet, cela signifie que l’ARN messager est prêt à être transporté hors du noyau, vers les ribosomes.
Un gène, plusieurs ARN messagers
Un même gène peut donner naissance à plusieurs ARN messagers différents. Par exemple, pour le gène de la dystrophine, il existe plusieurs séquences pour débuter ou terminer la transcription sur le gène et des variations sont aussi possibles au moment de la maturation de l’ARN pré-messager. Au total, il existe près de 20 formes de la dystrophine, plus ou moins longues, avec leurs propres spécificités (on parle d’isoformes).
De l’ARN messager à la protéine
Une fois dans le cytoplasme, l’ARNm est utilisé pour produire une protéine. On parle de traduction car le message porté par la séquence nucléotidique est traduit en une succession d’acides aminés, qui forme la protéine.
Grâce à l’ARN messager, il est possible de produire rapidement en grande quantité une protéine donnée : à partir d’un gène, de nombreux ARN messagers identiques sont fabriqués, chacun étant utilisé plusieurs fois pour fabriquer la protéine.
Et lorsqu’il faut arrêter la fabrication d’une protéine, l’ARN messager est détruit. Cela permet de réguler la quantité de protéine produite.
Contrairement à l’ADN qui est conservé tout au long de la vie de la cellule, les ARN messagers ne subsistent jamais longtemps, de quelques minutes à quelques heures.
Le saviez-vous ?
L’ARN messager a été découvert par trois chercheurs de l’Institut Pasteur de Paris : François Jacob, André Lwoff et Jacques Monod. En 1961, décrivant un des premiers modèles connus de régulation de l’information génétique, ils ont émis l’hypothèse qu’une molécule d’ARN, qu’ils appelèrent « messager », transmet cette information génétique de l’ADN vers les ribosomes. Ces travaux furent récompensés d’un prix Nobel en 1965. Par la suite, ils parvinrent à isoler l’ARN messager et confirmer son rôle.
Lire l’article de l’Institut Pasteur sur la découverte de l’ARN messager.
Qu'est-ce qu'un vaccin à ARN messager ?
Un vaccin à ARNm contient un ARN messager synthétique, fabriqué en laboratoire dans l’objectif de permettre à l’organisme de se défendre contre une infection. Les premiers vaccins à ARN messager commercialisés sont ceux contre la Covid-19 développés par les compagnies Pfizer-BioNTech et Moderna, commercialisés depuis 2020. Si ces vaccins ont pu bénéficier d’un développement rapide, c’est que des chercheurs travaillaient sur une telle approche depuis plusieurs décennies. Leurs recherches étaient déjà très avancées au début de la pandémie.
Les vaccins développés par Janssen et par AstraZeneca reposent de leur côté sur des vecteurs viraux non réplicatifs : de l’ADN codant la protéine Spike est intégré dans un virus différent du coronavirus (adénovirus) inactivé pour être inoffensif (il ne se multiplie pas dans les cellules).
L’ARN messager du vaccin peut-il pénétrer dans le noyau ?
L’ARN messager du vaccin pénètre dans le cytoplasme de la cellule, débarrassé de son enveloppe lipidique. Dès lors, il n’est plus protégé. Comme tout ARN messager, il est rapidement détruit à l’intérieur du cytoplasme. Il ne peut pas pénétrer à l’intérieur du noyau (il n’existe pas de mécanisme de transport capable de faire entrer une molécule d’ARN messager dans le noyau). Il n’interagit donc pas avec l’ADN.
Pour aller plus loin :
- AFM-Téléthon.fr : Vaccination contre la COVID-19
- Mesvaccins.net : L'ARN est-il l'avenir des vaccins ?
- Le site du Ministère de la santé : la vaccination contre la Covid-19
- CMT la nouvelle thérapie génique utilisant un ARN interférent
Une cible pour de nouveaux traitements
De nombreuses approches ciblant l’ARN messager sont à l’étude dans le domaine dans la santé. Pour les maladies neuromusculaires, par exemple :
- Dans l’amyotrophie spinale proximale liée à SMN1 (SMA), deux médicaments déjà disponibles pour les malades, le Spinraza® et l’Evrysdi® , agissent sur la maturation de l’ARN pré-messager du gène SMN2 et augmentent la quantité de protéine SMN, qui fait défaut dans la SMA.
- Dans la myopathie de Duchenne, plusieurs approches sont en développement pour corriger des anomalies de l’ARN pré-messager ou messager du gène DMD. La translecture du codon-stop cible spécifiquement les mutations de type « non-sens». C’est le cas de l’ataluren (Translarna®) qui a reçu une autorisation conditionnelle de mise sur le marché. Le saut d’exon modifie la maturation de l’ARN pré-messager pour rétablir la production d’une forme fonctionnelle de protéine issue du gène DMD, la dystrophine. Sept candidats-médicaments avec cette approche sont actuellement en développement. Quatre ont obtenu une autorisation de mise sur le marché aux États-Unis ou au Japon (mais encore aucun en Europe à ce jour).
- Dans la myopathie centronucléaire due à des anomalies des gènes DNM2 ou MTM1, un essai en cours en France évalue la sécurité d’utilisation et l’efficacité du DYN101, un oligonucléotide ciblant l’ARN pré-messager DNM2.
- Dans la glycogénose de type III, un essai clinique international évalue la bonne tolérance et l’efficacité d’un ARN messager thérapeutique codant l’enzyme manquante dans la maladie.
- Dans la maladie de Steinert, de nombreuses approches ciblant l’ARN messager DMPK muté sont en développement. Elles visent soit à le réparer grâce au système d’édition génomique CRISPR-Cas, soit à le détruire grâce à des oligonucléotides anti-sens optimisés.
- Dans la maladie de Charcot-Marie-Tooth de type 1A, les approches utilisant l’interférence par ARN ont montré des résultats prometteurs chez l’animal pour réduire la production excessive de protéine PMP22 en cause dans la maladie.
- Dans la myopathie facio-scapulo-humérale (FSH), une approche bloquant la maturation de l’ARN pré-messager au moment de l’ajout de la queue poly(A) du gène DUX4 a montré des résultats encourageants chez l’animal.
Des ARN médicaments
La plupart des traitements ciblant l’ARN messager sont eux-mêmes composés d’ARN : leurs séquences sont complémentaires de la séquence d’ARN messager qu’ils ciblent, ce qui leur permet de s’y fixer et d’entrainer soit une modification de la maturation de l’ARN pré-messager, soit sa dégradation.
Il s’agit d’oligonucléotides anti-sens, des petits ARN interférents, des micros ARN…

Comment fonctionnent les vaccins à ARN messager contre la Covid-19 ?
Les ARN messagers utilisés dans les vaccins contre la Covid-19 codent une protéine spécifique de ce virus, la protéine Spike. Ils sont introduits à l’intérieur de vésicules lipidiques microscopiques (liposomes) capables de fusionner avec les membranes des cellules. Cela permet de protéger et de faire pénétrer les ARN messagers à l’intérieur du cytoplasme des cellules.
Lors de la vaccination :